Cas9 RNPの安定性:Cas9 RNPは活性を保持したままどのくらい保存できる?
高効率のゲノム編集ツールを提供しています
IDTの社内実験の結果、Cas9を用いたゲノム編集では、gRNAとCas9タンパクから形成したRNP複合体を細胞に導入した際に、最大のゲノム編集効率が得られました(詳細:Improve your genome editing with the Alt-R™ S.p. Cas9 Nuclease 3NLS and modified crRNAs)。IDTでもこれらを取り扱っており、gRNAを構成するcrRNA及びtracrRNAは、化学修飾が施されているため分解されにくく、Cas9 タンパク質には核移行シグナルが付加されています。
RNPは活性を保ったまま保存できます
複合体を形成させたRNP(Alt-R gRNA:Alt-R Cas9 Nuclease)を、一度の実験で使い切る必要はありません。RNPは複合体を形成したまま保存でき、後の実験でも使用できることが、IDTの社内実験で示されています。活性を保持したまま保存可能なことは、余剰試薬を破棄せずに済むため、研究費を最大限に活かすことができます。また、一連の実験を一貫性をもって行う事もできます。さらに、複合体形成の手間も省けるため、より簡便に実験を進められます。
RNP安定性試験の方法
HPRT遺伝子の2つの異なる部位を標的とするcrRNAを用いて、RNPの保存安定性を調べました。ユーザーガイドにしたがって、Alt-R®シリーズの crRNA、 tracrRNA、 Cas9ヌクレースを用いて、RNP複合体を形成しました。そのRNP複合体をCas9 Buffer、Opti-MEM® media、PBSに対し、それぞれ1µMに調整しました。また、温度条件を4℃、 -20℃、 -80℃、試験期間を48時間、2週間、10週間としました。Alt-R CRISPR-Cas9 systemのユーザーガイドに従い、RNAiMAX(Thermo Fisher Scientific)を用いたリポフェクションで、それぞれの条件で保存したRNPをHEK-293細胞に導入しました。各試行を3回ずつ行い、その都度Cas9 Bufferで1µMに希釈したRNPの導入をコントロールとしました。
遺伝子導入した細胞を播種し、48時間培養を行ってから上述のユーザーガイドに従ってゲノムDNAを抽出しました。最後に、抽出したDNAのゲノム編集効率をT7E1アッセイで評価しました。図1に10週間の保存安定性試験の結果を示しています。
遺伝子導入した細胞を播種し、48時間培養を行ってから上述のユーザーガイドに従ってゲノムDNAを抽出しました。最後に、抽出したDNAのゲノム編集効率をT7E1アッセイで評価しました。図1に10週間の保存安定性試験の結果を示しています。
T7E1 Mismatch Endnuclease Assay
T7E1アッセイでは、PCRと電気泳動で、ゲノム編集で生じた変異を簡単に検出できます。T7E1は多種のPCRキットに対応しているため、切断の際にPCR産物の精製を行う必要もありません。T7E1アッセイを用いる際には、反応温度、時間、DNAと酵素の比率にご注意下さい[1]。T7E1は、2塩基以上の挿入や欠損を認識します[2]が、1塩基のインデル変異は認識できないので、実際のゲノム編集効率よりも低く評価されてしまいます。詳しくはこちらの「Mutation detection in CRISPR experiments」をご参照下さい。
RNP安定性試験の結果
図1は、10週間保存したRNPを用いてゲノム編集を行った結果です。4℃、-80℃で10週間保存しても、3種のバッファー全てで活性は落ちませんでした。-20℃で保存した場合のみ、site2の活性が低下しました。この結果は、サイトの選択が保存活性にも影響する事を示唆しています。そのため保存の観点からも、ターゲットの2~3サイトに対して、crRNAをデザインする事を推奨します。今回のデザインでは、HPRTのsite1がsite2よりも常に効率的だったことが分かります。
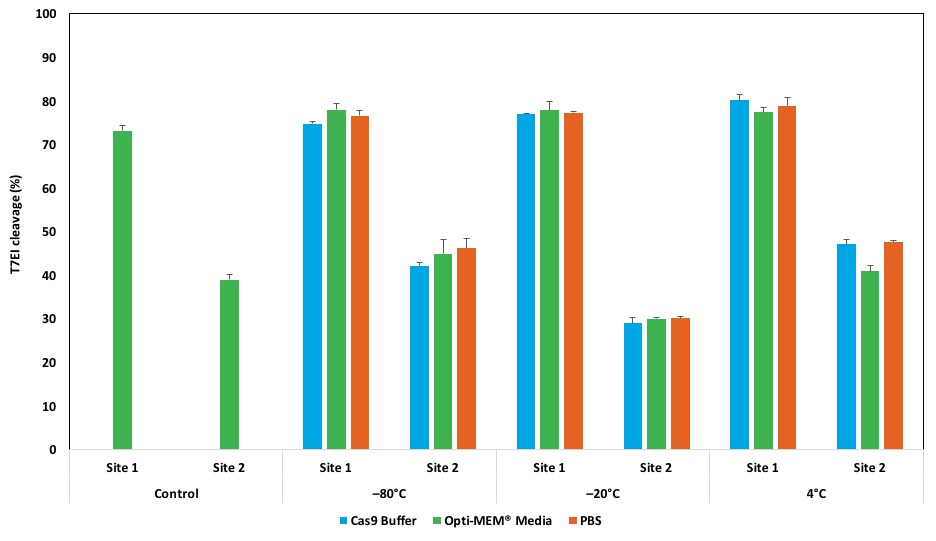
図1.Cas9 RNP複合体は、4℃、-80℃で10週間保存しても高い活性を保持しています。
「RNP安定性試験の方法」に従って実験を行いました。2つのHPRT遺伝子サイトには、site1 = 38087、site2 = 38285 を用いました。本Figでは、試験期間:10週間の場合を記載しております。4℃、-80℃で10週間保存しても、新しく複合体を形成したRNPと同様の活性を示しました。
-80℃で5ヶ月保存した場合のデータは下記ポスターの左下の図Dをご参照ください。
The spectrum of NHEJ products following CRISPR/Cas9 DNA cleavage is target site dependent

図1.Cas9 RNP複合体は、4℃、-80℃で10週間保存しても高い活性を保持しています。
「RNP安定性試験の方法」に従って実験を行いました。2つのHPRT遺伝子サイトには、site1 = 38087、site2 = 38285 を用いました。本Figでは、試験期間:10週間の場合を記載しております。4℃、-80℃で10週間保存しても、新しく複合体を形成したRNPと同様の活性を示しました。
-80℃で5ヶ月保存した場合のデータは下記ポスターの左下の図Dをご参照ください。
The spectrum of NHEJ products following CRISPR/Cas9 DNA cleavage is target site dependent
RNPを保存する時は
IDTでは、Alt-R CRISPR Cas9 RNPを保存する場合、4℃であれば2週間まで。それ以上の場合は-80℃を推奨します。4℃の場合、コンタミネーションにより細菌や真菌が繁殖する可能性があるためです。
本実験により、Alt-R CRISPR-Cas9 Systemで形成したRNPは、安定性の高い試薬である事が示されました。時間と試薬代の節約になり、また実験のスケジュールリングも容易になります。本方法を用いれば、複合体形成時の活性を保持したまま保存することができます。
Alt-R CRISPR-Cas9 RNP複合体を用いてゲノム編集を行っている方は、ぜひ下記のAdditional Readingも参考にしてください。また、リポフェクションのプロトコールは、ユーザーガイドをご覧下さい。
本実験により、Alt-R CRISPR-Cas9 Systemで形成したRNPは、安定性の高い試薬である事が示されました。時間と試薬代の節約になり、また実験のスケジュールリングも容易になります。本方法を用いれば、複合体形成時の活性を保持したまま保存することができます。
Alt-R CRISPR-Cas9 RNP複合体を用いてゲノム編集を行っている方は、ぜひ下記のAdditional Readingも参考にしてください。また、リポフェクションのプロトコールは、ユーザーガイドをご覧下さい。
References
- Mean RJ, Pierides A, et al. (2004) Modification of the enzyme mismatch cleavage method using T7 endonuclease I and silver staining. Biotechniques, 36(5):758–760.
- Vouillot L, Thélie A, Pollet N. (2015) Comparison of T7EI and Surveyor mismatch cleavage assays to detect mutations triggered by engineered nucleases. G3: Genes|Genomes|Genetics, 5(3):407–415.
- 原文:Genome editing: How stable is my CRISPR RNA:Cas9 RNP complex? Prepare and store CRISPR RNA:Cas9 RNP complexes for several weeks with no loss in activity
- 翻訳:安井 孝彰
製品フォーカス
Alt-R® CRISPR-Cas9 System
Alt-R® CRISPR-Cas9 Systemには、ゲノム編集を行うためのキーとなる試薬が揃っています。S. pyogenesの持つCRISPR-Cas9 systemに由来する本システムは、下記の様に多数のアドバンテージがあります。- 他社の手法と比較し、オンターゲット率が向上します。
- Cas9 RNPが正確にされます。
- リポフェクションやエレクトロポレーションで、効率よくRNPが導入できます。
- sgRNAやCas9 mRNAの様に、自然免疫を惹起しません。
Alt-R® CRISPR-Cpf1 System
Alt-R® CRISPR-Cpf1 Systemを用いると、これまでCRISPR-Cas9で切断できなかったサイトでゲノム編集を行えます。Cpf1でDNAを切断すると、5'突出末端となります。本試薬には下記の特徴があります。
- AT-richなゲノム領域でもゲノム編集が行えます。
- Cas9では切断できなかったサイトを補填できます。
- Cpf1 NucleaseとcrRNAのみで、ゲノム編集を行えます。tracrRNAは必要ありません。
- エレクトロポレーション法で効率よくRNPを導入できます。