農研機構 生物機能利用研究部門 カイコ機能改変技術開発ユニット 坪田先生 インタビュー
カイコの遺伝子組換え技術の歴史とゲノム編集技術応用
カイコは養蚕・蚕糸業に利用されている昆虫で、私たち日本人にとっては大変馴染みの深い生き物です。
カイコは生理学・分子生物学・病理学などの研究材料に利用され、また近年ではカイコを用いた新たな産業の創出に向けた取り組みが活発に進められています。
今回は、カイコの遺伝子組換えやゲノム編集技術の開発に取り組んでいる坪田拓也先生にお話を伺いました。
カイコの遺伝子組換え技術の歴史とゲノム編集技術応用
私たちの研究グループでは、今から約20年前に世界で初めて遺伝子組換えカイコの作出に成功しました。昆虫では、遺伝子組換えは通常卵に遺伝子を注射することによって行います。カイコでも同様の方法に従いますが、その際カイコには他の昆虫に見られない特有の問題があります。それは、カイコの卵が非常に固い卵殻で覆われているということです。
ショウジョウバエなどで注射を行う場合、ガラスキャピラリーを卵に刺して遺伝子の注入を行えば問題ありませんが、カイコで同様のことを行うと、卵殻が固くガラスキャピラリーが折れてしまって遺伝子の注入ができません。
そこで私たちは、一度金属(タングステン)の針でカイコの卵に微小な穴をあけ、その穴にガラスキャピラリーを刺して遺伝子を注入するという技術を開発しました。この方法を利用することで、300-400個の卵に注射を行うことで次世代で組換えカイコを獲得することができます。 組換えカイコは様々な目的に利用することができます。まず始めに、カイコの遺伝子機能解析のための利用を挙げることができます。
解析したい遺伝子を組換えて、本来発現していない時期や組織で発現させて表現型の変化を観察したり、あるいは突然変異体の候補遺伝子を組換えて表現型の回復を観察したりすることで、遺伝子の機能を明らかにすることができます。
これまで、脱皮・変態やウィルス抵抗性に関わる遺伝子の機能などが、組換えカイコを用いて明らかにされてきました。
次に、組換えカイコによる有用タンパク質の生産を挙げることができます。カイコは大型の昆虫で、大量のタンパク質を合成する能力があり、有用タンパク質を合成するための遺伝子を導入した組換えカイコを用いて大量のタンパク質を生産させることができます。
組換えカイコにより生産された化粧品や医薬品の中には、すでに市場に出ている製品もあります。3つ目として、組換えカイコによるシルクの機能改変を挙げることができます。
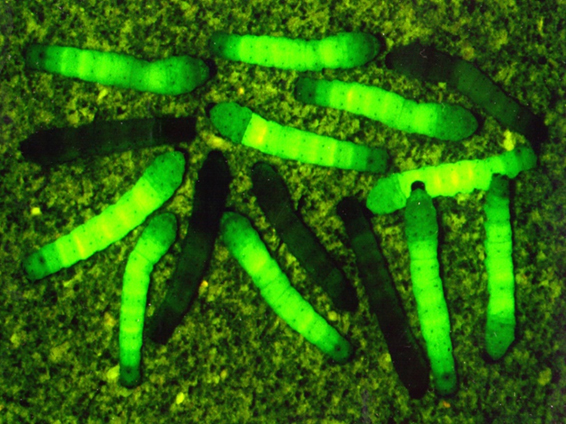
カイコは幼虫から蛹になる際に繭(シルク)を作ります。組換えカイコを用いることで、高付加価値を持たせたシルクを作らせることが可能で、私たちはこれまでに様々な美しい色に光る蛍光シルクや(図1)、切れにくい性質を持つクモ糸シルクを生産するカイコの開発に成功しています。
カイコにおけるゲノム編集技術の開発
ゲノム編集技術が登場して以来、私たちはいち早くカイコでのゲノム編集技術の開発に取り組んできました。2010年にはZFNによるゲノム編集、2013年にはTALENによるゲノム編集、そして2014年にはCRISPR/Cas9によるゲノム編集に成功しています。カイコではTALENの効率がCRISPR/Cas9に比べて高く、TALENは現在カイコで最も汎用的に利用されているゲノム編集ツールです。
一方で、CRISPR/Cas9の効率化に向けた取り組みも私たちは進めており、Cas9のmRNAではなくタンパク質を利用することで、高効率でゲノム編集を行えることが明らかになりつつあります。
カイコを材料に研究を行っている方で、これからゲノム編集をご自身の研究に取り入れようと考えている方がおられましたら、少なくともノックアウト解析を行う分には、CRISPR/Cas9の利用で問題ないでしょう。 一方で、カイコの産業利用をさらに進める上では、プラスミドサイズの遺伝子をゲノムの狙った場所に挿入する「ノックイン」技術の開発が不可欠です。
ノックインはノックアウトに比べてもう一段階レベルの高い技術であり、私たちはこれまで相同組換え法などを利用してノックイン技術の開発を進めてきましたが、実用的に使える効率には至らず開発は困難をきわめました。
しかしながら、2014年にブレークスルーがあり、マイクロホモロジー媒介末端結合(MMEJ)を利用したノックイン技術であるPITCh(ピッチ)法を利用することで、カイコで高効率でノックインを起こすことに成功しました(ref1)。
ノックインにより緑色に光るカイコを見たときの感動は今でも忘れられません(図2)。カイコではTALENベースのPITCh法であるTAL-PITCh法が今のところ有効ですが、CRISPR/Cas9ベースのPITCh法も原理的には可能であり、現在開発を進めているところです。
PITCh法は、カイコの変異系統の維持の効率化や有用タンパク質の生産量の向上など、様々な目的に利用できる技術で、カイコ研究全般の推進に貢献するものであると期待されます。
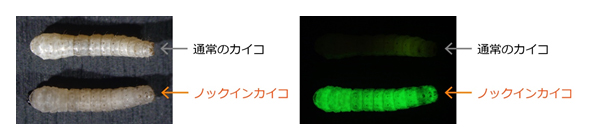
図2. PITCh法により作出したBLOS2遺伝子座へのノックインカイコ
左が白色光下で観察した写真、右が蛍光下で観察した写真で、上が通常のカイコ、下がノックインカイコを示す。
ノックインカイコでは、BLOS2遺伝子の破壊により皮膚が透明になっており、かつgfp遺伝子の挿入による緑色の蛍光が観察される。
カイコ研究の今後の展望
養蚕業は近代日本の発展に大きく貢献してきましたが、生活様式の洋風化や、海外からの安価なシルク製品の流入などにより、現在わが国では養蚕業はほぼ産業としては成り立っていない状況です。そのような状況の中、遺伝子組換えやゲノム編集など最新のバイオテクノロジーを利用して、カイコによる新たな産業の創出を目指す取り組み(私たちはこれを「蚕業革命」と呼んでいます)が近年活発化しています。
先に述べましたように、組換えカイコを用いた医薬品の生産などはすでに一部産業化が進められていますが、さらに強力に産業化を進めるためには、ゲノム編集は間違いなく要となる技術です。
例えば、ゲノム編集により有用タンパク質遺伝子をカイコの内在性の強力発現領域に「狙って」挿入できれば、有用タンパク質の生産量が飛躍的に向上することが期待されます。同様に、蛍光を強力に発するシルクや超強力なシルクを生産するカイコの開発も可能になるでしょう。
また、カイコの産業利用がさらに進み、一般養蚕農家でのカイコの飼育が普及すると、農家で飼いやすいカイコを「育種」することが不可欠になることが見込まれます。ゲノム編集は、このような育種の迅速化・効率化にも利用できると考えられます。
一方で、ゲノム編集は基礎研究の進展にも貢献するもので、これまでカイコで効きがよくなかったRNAiの代替ツールとして、ゲノム編集を用いたノックアウトによる遺伝子機能解析が定法となりつつあります。
カイコは基礎から応用研究まで幅広い用途に利用できる、大変魅力ある研究材料です。カイコに興味のある方、特にカイコのゲノム編集研究に興味のある方は、どうぞお気軽にご相談ください。
Reference
1.Nakade S, et al: Nat Commun 2014; 5: 5560研究者紹介
 |
坪田 拓也
|
製品フォーカス
Alt-R® CRISPR-Cas9 System
Alt-R® CRISPR-Cas9 Systemには、ゲノム編集を行うためのキーとなる試薬が揃っています。S. pyogenesの持つCRISPR-Cas9 systemに由来する本システムは、下記の様に多数のアドバンテージがあります。- 他社の手法と比較し、オンターゲット率が向上します。
- リポフェクションやエレクトロポレーションで、効率よくRNPが導入できます。
- sgRNAやCas9 mRNAを導入した際に見られる、自然免疫を惹起しません。
Alt-R® CRISPR-Cas12a System
Alt-R® CRISPR-Cas12a Systemを用いると、これまでCRISPR-Cas9で切断できなかったサイトでゲノム編集を行えます。Cpf1でDNAを切断すると、5'突出末端となります。本試薬には下記の特徴があります。
- AT-richなゲノム領域でもゲノム編集が行えます。
- Cas9では切断できなかったサイトを補填できます。
- Cas12a NucleaseとcrRNAのみで、ゲノム編集を行えます。tracrRNAは必要ありません。
- エレクトロポレーション法で効率よくRNPを導入できます。
