IDTテクニカルレポート vol.1

塚本 智史(主任技術員)
はじめに
通常は、専用に開発されたpX330ベクター[1]などにsgRNAの認識配列となるオリゴDNAをクローニングすることで、これら2つの因子を発現するベクターを構築する。しかし、筆者は人工の二本鎖DNAであるgBlocks®を用いることで、プラスミドを構築する手間なくsgRNAを精製し、Cas9ヌクレアーゼと共に受精卵へ顕微注入することでノックアウトマウスを作出している(次ページ図1参照)。本レポートでは、gBlocks®を利用したCRISPR/Cas9によるノックアウトマウスの作製法について解説する。
準備するもの
● T7プロモーターから転写可能なsgRNAの全長をコードする二本鎖DNA(gBlocks®,IDT-MBL KK)
● T7プロモーターから転写可能なCas9をコードするDNA(プラスミドやPCR産物など)
AddgeneやSigma-Aldrich Co. LLC.から入手・購入可能。最近では、Cas9のmRNAやペプチドも市販されている。
● mMESSAGE mMACHINE T7 ULTRA Transcription Kit(Life TechnologiesTM,Thermo Fisher Scientific Inc.)
Cas9 mRNA転写用
● MEGAshortscript T7 Kit(Life TechnologiesTM,Thermo Fisher Scientific Inc.)
sgRNA転写用
● MEGAclear Kit(Life TechnologiesTM,Thermo Fisher Scientific Inc.)
in vitroで転写したmRNAの精製に使用する。筆者は、フェノール・クロロホルムによる除タンパク質とエタノール沈殿でも精製しているが、MEGAclear Kitを使用した方がmRNAの回収量が多いようである。
● Surveyor® Mutation Detection Kits(IDT-MBL KK)
標的配列内の変異導入の有無を解析するためのキット(必要に応じて準備する。sgRNAの認識配列内に制限酵素配列がない場合など)。
● Ultrafree-MC centrifugal filter(Merck Millipore, Merck KGaA)
顕微注入の直前に本カラムを使って精製したmRNAから不純物を除去している。
● Guide-it sgRNA Screening Kit(タカラバイオ株式会社)
gBlocks®を鋳型にして精製したsgRNAの標的部位に対する切断活性を確認するためのキット。
● マウス
雌マウスは8?12週齢、雄マウスは9週齢以上、移植用仮親マウス(ICR/MCH、精管結紮雄と同居させて移植当日の朝に膣詮が確認できたもの)、里親マウス(ICR/MCH)。
筆者は、C57BL/6マウスの体外受精卵(1細胞、受精5時間目頃)を用いることが多いが、状況に応じて凍結しておいた1細胞も用いている。
● 受精卵へRNAを顕微注入するためのマニュピュレーターシステム
筆者はLeica Microsystems K.K.の顕微鏡(DMI3000B)とマニュピュレーターシステムを使用している。
インジェクション針はSutter Instrument Companyのピペットプラー(IVF-P98)を用いてその都度作製している。
プロトコル
 gBlocks®を利用したCRISPR/Cas9による変異マウス作出の流れを示す。標的遺伝子のゲノム情報取得からgBlocks®のオーダーと納品、gBlocks®を鋳型にしたsgRNAの精製と切断活性の確認までに2週間、受精卵への顕微注入からマウスの誕生までに3週間の期間(最短で一ヶ月半ほど)で目的とする変異マウスの作出が可能となる。
gBlocks®を利用したCRISPR/Cas9による変異マウス作出の流れを示す。標的遺伝子のゲノム情報取得からgBlocks®のオーダーと納品、gBlocks®を鋳型にしたsgRNAの精製と切断活性の確認までに2週間、受精卵への顕微注入からマウスの誕生までに3週間の期間(最短で一ヶ月半ほど)で目的とする変異マウスの作出が可能となる。1. sgRNAの標的配列の選定からgBlocks®のオーダー
>> gBlocksの納品量は250ngに増量しました。(?250bp)
250bp?500bpでは、500ngの納品です。
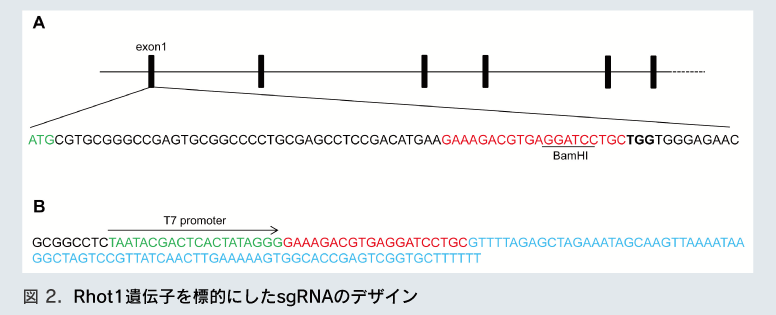
A. Rhot1遺伝子エクソン1の開始コドンを緑色、sgRNA認識配列を赤字、認識配列内の制限酵素サイト(BamHI)を下線、PAM 配列を太文字で示す。 B. sgRNAを精製するために必要なgBlocks®の全長(130 bp)のDNA配列。5’末端側からBuffer Sequence(黒色)、T7プロモーター(緑色)、sgRNA認識配列(赤色)、sgRNA scaffold配列(青色)を示す。
※ Buffer Sequence : 125 bp以上必要となるgBlocks®を合成するための配列。
2. gBlocks®を鋳型にしたsgRNAの転写とin vitroでの切断活性の確認
3. RNA-injectionによる受精卵への導入とスクリーニング
4. 変異マウスの検出
著者所感)筆者の経験では、本法で作出した変異マウスは両アレルに変異を持つホモ型の変異であることが多い。この原因はよく分からないが、受精卵へ顕微注入するsgRNAやCas9のmRNA濃度や受精後の導入時間などが影響するのかもしれない。
実験例

顕微注入後に発生した76個の2細胞のうち、移植した60個から20匹のマウスが誕生した(図3 A)。マウスの尻尾から抽出したゲノムDNAを用いて、標的配列を含む領域をPCRで増幅して制限酵素BamHIで処理してアガロースゲルに泳動した写真を示す(図3 B)。野生型(Wt:変異導入がない)マウスでは、増幅したPCR産物(560 bp:図3 B矢印)が切断され400 bpと160 bp付近の2本のバンド(図3 B矢頭)として検出された。一方で変異導入されたマウス(No.1~20)ではPCR産物の切断は確認されなかった(図3 B)。同様にSurveyor Mutation Detection Kitsを用いた解析から、変異導入されたマウス(No.1~20)でのみSurveyorヌクレアーゼで切断されたバンド(図3 C矢頭)が検出された(図3 C)。変異導入が予測されたマウス10匹(No.1~10)のシークエンス解析の結果を図3 Dに示す。波形データを解析した結果、10匹のうち4匹(No.1、8、9、10)は両方のアレルに同じ変異が導入されたホモ型の変異で、残りはアレルごとに異なったパターンの変異が導入されたヘテロ型の変異マウスであると考えられる(図3 B・C写真提供:放射線医学総合研究所 研究基盤センター 生物研究推進課 伊林恵美氏)。
著者注記)出生した20匹のマウスのうちNo.12はシークエンス解析によって両アレルの変異を確認している
まとめ
[1] Cong, L. et al., Science. 339, 819-23, 2013. PMID: 23287718
[2] Chang, N. et al., Cell Res. 23, 465-72, 2013. PMID: 23528705
[3] Nguyen, T.T. et al., Proc Natl Acad Sci USA. 111, E3631-40, 2014. PMID: 25136135
gBlocks®のご紹介
またその正確性から、クローニングを行なっていないgBlocks®や、そのgBlocks®を用いて転写したタンパク質によるスクリーニングも行われています。
詳細はこちら >>gBlocks® Gene Fragments:人工遺伝子合成受託サービス
Surveyor®のご紹介
詳細はこちら >>遺伝子/ DNAの変異/多型検出キット: Surveyor® Mutation Detection Kits