最適なビオチン修飾を選ぶには
ビオチン修飾はストレプトアビジンとの高い親和性を持つ、分子生物学のアプリケーションに於いて重要な分子です。(参照:いかにしてビオチンは分子生物学社のツールになったか)Mobility Shift Assays法や濃縮、精製、個体面への接着や、ストレプトアビジンをラベルした蛍光色素や酵素に対しても用いられています。このビオチン-ストレプトアビジンの相互作用は非常に強力で、解離定数(Kd)は、10-15Mにもなります。
ビオチンはストレプトアビジンタンパク内のポケットにスッポリと収まります(Fig.1)[1]。ストレプトアビジンがビオチンを「包み込む」事により、2因子間の相互作用はさらに強くしています。ビオチンはこの「包み込み」により多くの研究者に好まれる使い勝手の良いツールとなっているのです。
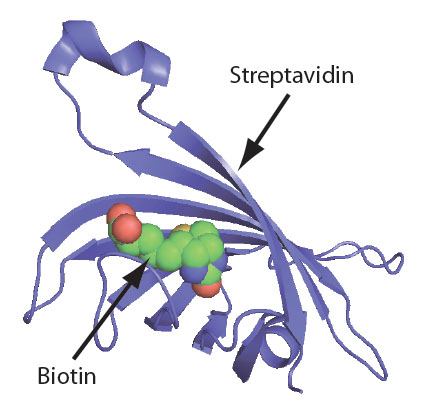
Figure 1. ビオチンとストレプトアビジンの相互作用。ビオチン(緑/赤/青球)がストレプトアビジンタンパク質(青色リボン)の内側ポケットにぴったりと嵌る。[2]
ビオチンはストレプトアビジンタンパク内のポケットにスッポリと収まります(Fig.1)[1]。ストレプトアビジンがビオチンを「包み込む」事により、2因子間の相互作用はさらに強くしています。ビオチンはこの「包み込み」により多くの研究者に好まれる使い勝手の良いツールとなっているのです。

Figure 1. ビオチンとストレプトアビジンの相互作用。ビオチン(緑/赤/青球)がストレプトアビジンタンパク質(青色リボン)の内側ポケットにぴったりと嵌る。[2]
ビオチン修飾とその種類
ビオチン修飾はオリゴヌクレオチドの両末端に付加できます(Standerd Biotin)。また、ビオチン修飾を施したT塩基をオリゴヌクレオチドの内側に配置することも出来ます(Biotin-dT)。ビオチン修飾には種類がいくつもありますが、それぞれに利点があります。
Standerd Biotin
IDTでは、5'末端もしくは3'末端へのビオチン修飾はスタンダードなC6スペーサーを用います(Fig.2)。IDTで「ビオチン修飾」といえばこちらの修飾を指し、ほとんどのアプリケーションに対して、こちらの修飾をお勧めしています。
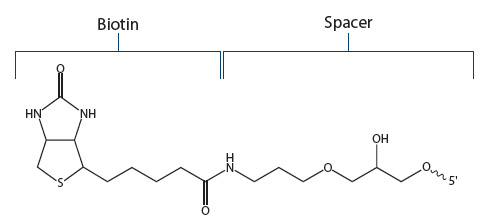
Figure 2. Standerd Biotin. Figは3'末端へ修飾するためのビオチンです。
Biotin dT
ビオチン修飾をチミジン塩基に行うことにより、ビオチンをオリゴヌクレオチド内に配置することが出来ます。なお、Biotin dTを5'末端もしくは3'末端に配置することも可能です。
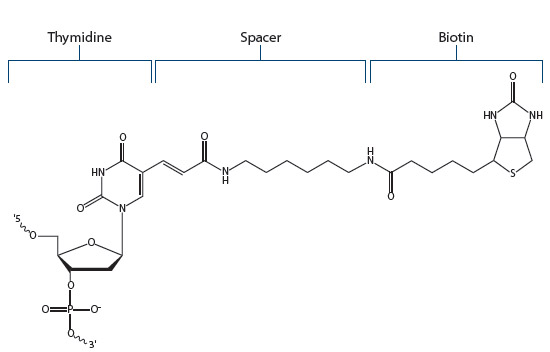
Figure 3. Biotin dT.
Biotin-TEG
Biotin-TEGは、ビオチン-オリゴヌクレオチド間の距離をトリエチレングリコール(triethyleneglycol)を用いて15atom離した修飾オリゴです。立体障害の回避やオリゴヌクレオチドにマグネティックビーズやNanospheresを付加に良く使われています。
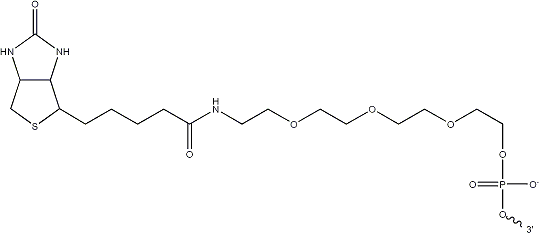
Figure Add1. Biotin-TEG. Figは5'末端へ修飾するためのBiotin-TEGです。
Dual Biotin
デュアルビオチンは2つのビオチンを有した修飾です(Fig.4)。ビオチンとストレプトアビジンの相互作用を増加させるため、SAGE(Serial Analysis of Gene Expression)など、精度を要求される実験に用いられます。
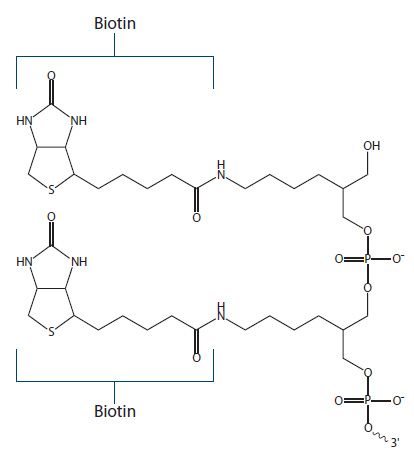
Figure 4. Dual Biotin.
結合後のビオチンをコントロール出来るビオチン修飾 (PC Biotin & DestihoBiotin-TEG)
ビオチンを用いた実験において最も苦心するのが、ビオチン-ストレプトアビジンの不可逆性です。pHや温度変化ではその結合を切ることは出来ません。またストレプトアビジンがビオチンを離すのに必要な条件では、その後の実験にネガティブな結果を及ぼしてしまう可能性があります。
IDTでは、結合とリリースをコントロールする2種類の修飾を用意しています。
PC Biotin
PC Biotinは、ビオチン基とDNA塩基間に、光切断スペーサー(photocleavable spacer)が挿入されています。最適切断条件は、300-350nmのUV波長です。切断されたオリゴの5'末端はリン酸基となっており、そのままライゲース処理も可能です。
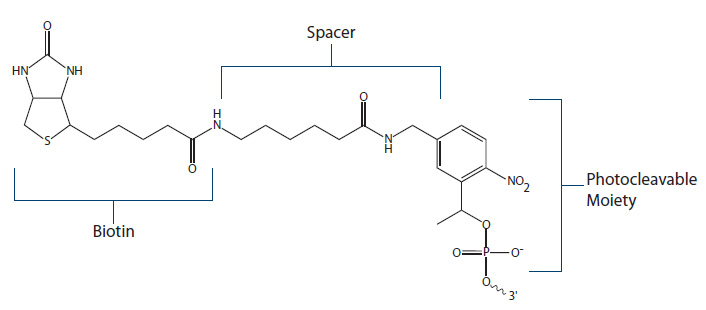
Figure 5. PC Biotin.
DestihoBiotin-TEG
デスチオビオチンはS原子を含まないビオチンのアナログで、ビオチン-ストレプトアビジン複合体をコントロールするもう一つの選択肢です。このアナログは、ストレプトアビジンと強固に結合しますが、"Standard"なビオチンほどではありません。これを利用し、ビオチンを含むバッファーでデスチオビオチン-ストレプトアビジン複合体をwashすると、ストレプトアビジンがビオチンと結合し、デスチオビオチンがストレプトアビジンからリリースされます。[3]
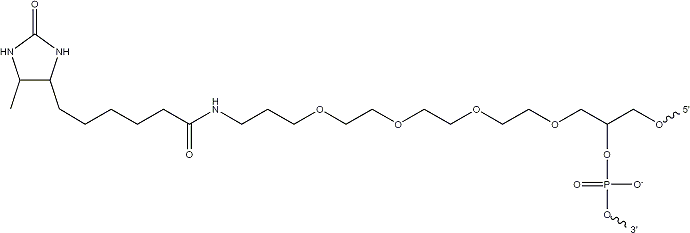
Figure Add2. DestihoBiotin-TEG.
Biotin Azide
ついにビオチンもクリック法を用いて5'末端あるいはインターナルにビオチンを付加出来るようになりました。こちらは参照記事がございますので、こちらをご参照下さい。
Standerd Biotin 
IDTでは、5'末端もしくは3'末端へのビオチン修飾はスタンダードなC6スペーサーを用います(Fig.2)。IDTで「ビオチン修飾」といえばこちらの修飾を指し、ほとんどのアプリケーションに対して、こちらの修飾をお勧めしています。

Figure 2. Standerd Biotin. Figは3'末端へ修飾するためのビオチンです。
Biotin dT 
ビオチン修飾をチミジン塩基に行うことにより、ビオチンをオリゴヌクレオチド内に配置することが出来ます。なお、Biotin dTを5'末端もしくは3'末端に配置することも可能です。

Figure 3. Biotin dT.
Biotin-TEG 
Biotin-TEGは、ビオチン-オリゴヌクレオチド間の距離をトリエチレングリコール(triethyleneglycol)を用いて15atom離した修飾オリゴです。立体障害の回避やオリゴヌクレオチドにマグネティックビーズやNanospheresを付加に良く使われています。
Figure Add1. Biotin-TEG. Figは5'末端へ修飾するためのBiotin-TEGです。
Dual Biotin 
デュアルビオチンは2つのビオチンを有した修飾です(Fig.4)。ビオチンとストレプトアビジンの相互作用を増加させるため、SAGE(Serial Analysis of Gene Expression)など、精度を要求される実験に用いられます。
Figure 4. Dual Biotin.
結合後のビオチンをコントロール出来るビオチン修飾 (PC Biotin & DestihoBiotin-TEG)
ビオチンを用いた実験において最も苦心するのが、ビオチン-ストレプトアビジンの不可逆性です。pHや温度変化ではその結合を切ることは出来ません。またストレプトアビジンがビオチンを離すのに必要な条件では、その後の実験にネガティブな結果を及ぼしてしまう可能性があります。
IDTでは、結合とリリースをコントロールする2種類の修飾を用意しています。
PC Biotin 
PC Biotinは、ビオチン基とDNA塩基間に、光切断スペーサー(photocleavable spacer)が挿入されています。最適切断条件は、300-350nmのUV波長です。切断されたオリゴの5'末端はリン酸基となっており、そのままライゲース処理も可能です。
Figure 5. PC Biotin.
DestihoBiotin-TEG 
デスチオビオチンはS原子を含まないビオチンのアナログで、ビオチン-ストレプトアビジン複合体をコントロールするもう一つの選択肢です。このアナログは、ストレプトアビジンと強固に結合しますが、"Standard"なビオチンほどではありません。これを利用し、ビオチンを含むバッファーでデスチオビオチン-ストレプトアビジン複合体をwashすると、ストレプトアビジンがビオチンと結合し、デスチオビオチンがストレプトアビジンからリリースされます。[3]
Figure Add2. DestihoBiotin-TEG.
Biotin Azide 
ついにビオチンもクリック法を用いて5'末端あるいはインターナルにビオチンを付加出来るようになりました。こちらは参照記事がございますので、こちらをご参照下さい。Modifications
IDTでは他にも多種の修飾を取り扱っています。こちらのページをご参照下さい。もしご希望の修飾が見つからない場合は、japan-cc@idtdna.comまでリクエストして下さい。
オーダー方法
ビオチン修飾は、IDTウェブサイトからご注文頂けます。リンク先の「5'末端、インターナル、3'末端のタブ」から修飾を選択して下さい。
なお、スタンダードビオチン以外は、100nmoleスケール以上、HPLC精製が必要です。
なお、スタンダードビオチン以外は、100nmoleスケール以上、HPLC精製が必要です。
References
- DeChancie J, Houk KN (2007) The origins of femtomolar protein–ligand binding: hydrogen bond cooperativity and desolvation energetics in the biotin–(strept)avidin binding site. J Am Chem Soc, 129(17):5419–5429.
- Weber PC, Ohlendorf DH, et al (1989) Structural origins of high-affinity biotin binding to streptavidin. Science, 243:85–88.
- Hirsh JD, Eslamizar l, et al. (2002) Easily reversible desthiobiotin binding to streptavidin, avidin, and other biotin-binding proteins: uses for protein labeling, detection, and isolation. Anal Biochem, 308(2):343–357.
- 原文(IDT Scientific Article):Which Biotin Modification to Use?
- 翻訳:安井 孝彰